蛋白质修饰的常用策略
▉ 摘要

图1、生物正交反应(含有生物正交片段的A和B)
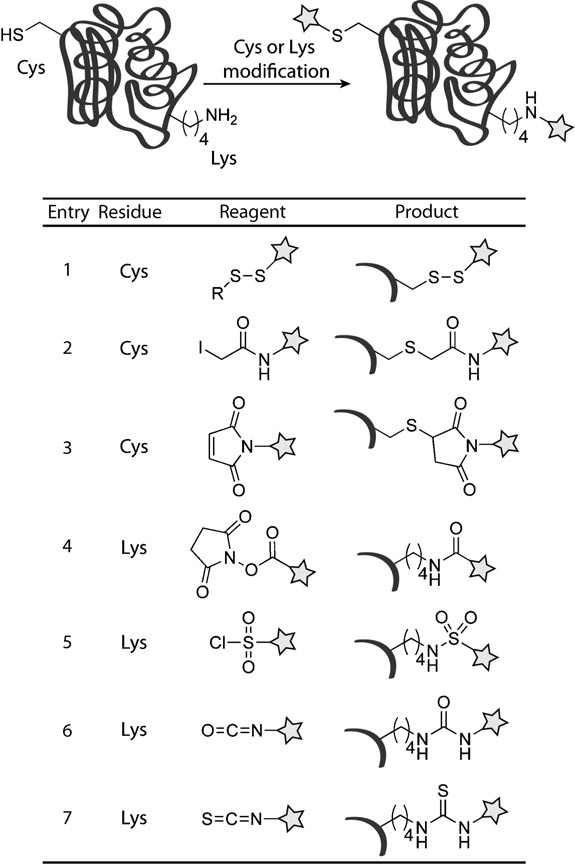
相比之下,其余18个组成蛋白的氨基酸由于反应活性和选择性发生修饰可能性很小。通过用重氮盐,碘或亚硝酸的亲电取代反应可以修饰酪氨酸的苯酚部分,谷氨酸和天冬氨酸可以通过碳二酰亚胺与氨基发生偶联【1】。
▉蛋白质修饰的新型方法
目前已经开发了新方法用于修饰半胱氨酸,赖氨酸,酪氨酸和色氨酸(图3A),这些现代方法中许多涉及金属介导的转化,且主要是关于N末端进行修饰。
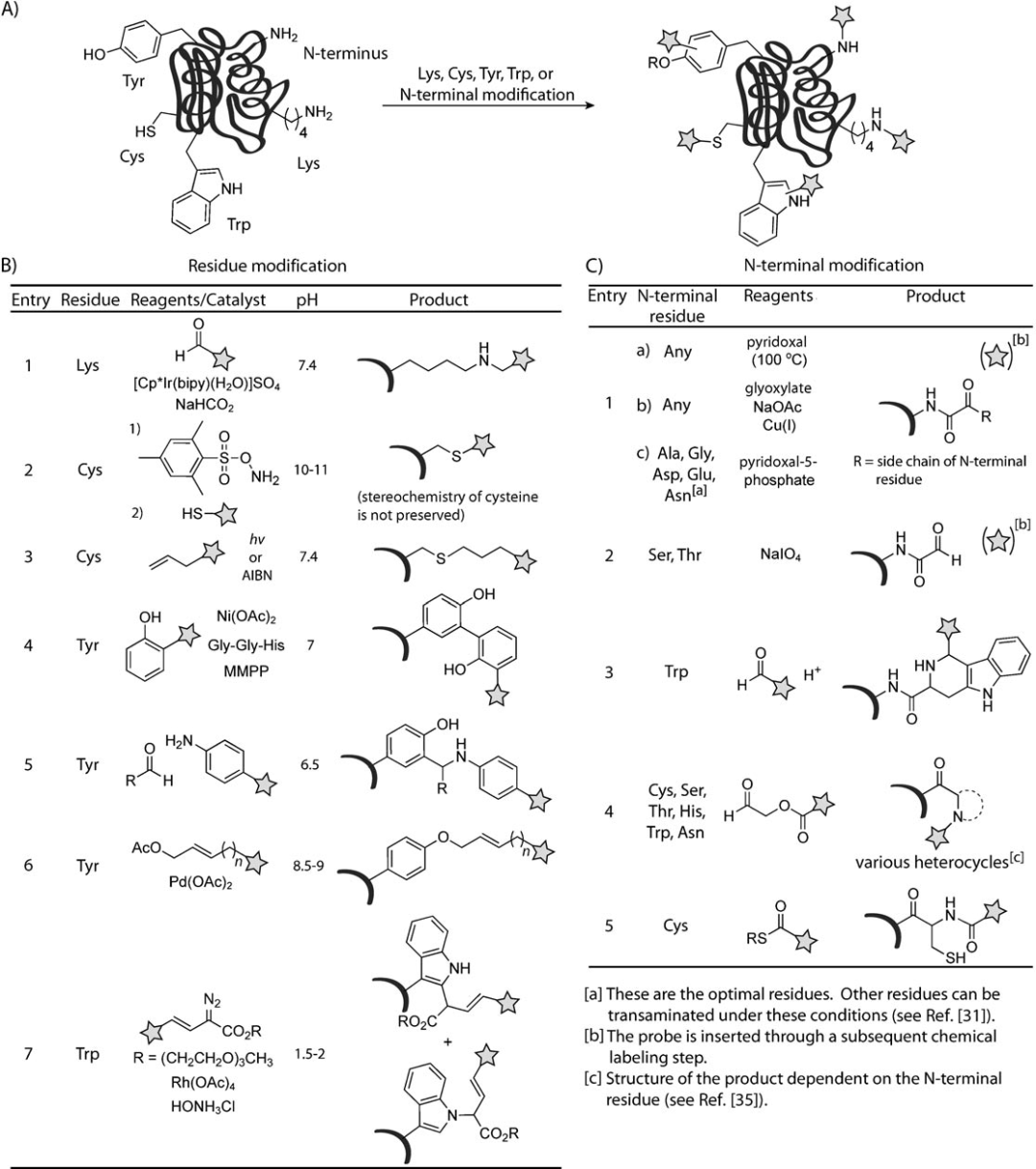
图3、蛋白质修饰的现代生物偶合反应
▉赖氨酸和半胱氨酸修饰的新一代反应
虽然赖氨酸和半胱氨酸相关的经典生物杂交技术已经被广泛使用,但是在胺和硫醇的选择性修饰的上一直在不断开发和优化。McFarland和Francis报告了一种特异性的还原烷基化反应,通过铱催化的转移氢化进行,与需要酸性条件的基于氰基硼氢化钠的经典反应不同,铱介导的过程在pH 7.4条件下可以以较高产率发生(图3B)。Davis和其同事开发了一个两步修饰半胱氨酸的方法,第一步与磺酸羟胺在基础条件下反应生成脱氢丙氨酸,然后和硫醇发生迈克尔加成,由于迈克尔加成不具备立体选择性,因此得到的修饰是非对映异构体。另外也有与光照产生的自由基相关的反应(图3B)。4
▉酪氨酸和色氨酸相关的修饰
酪氨酸和色氨酸等主要出现在蛋白表面上,且相对罕见,因此为定点修饰提供了可能性。Kodadek et al首次使用镍(II)催化剂和氧化剂实现对蛋白质的修饰, Francis和其同事通过胺醛mannich反应以及 π-烯丙基钯反应实现对酪氨酸的修饰(图3B)。
▉N末端的化学修饰
蛋白质的N末端具有独特的pH依赖性反应性,因此是实现定点修饰的靶标,其相对于赖氨酸侧链上的氨基的较低的PKa值可以导致选择性酰化或烷基化。N端修饰的技术可以追溯到1956年,Bonetti和其团队发现100度的条件下,各种氨基酸均可以被修饰,但此时蛋白发生了变性,大概10年后,Dixon在常温下用乙醛酸盐,催化碱和亚铜的作用下也可以实现对N端氨基酸进行乙醛酸修饰。后续又慢慢发展了针对不同氨基酸的特定的修饰(图3C)。
▉天然化学连接(NCL)
1994年,肯特和同事发现用N-末端半胱氨酸残基与硫代酯连接后通过S-N酰胺反转得到“天然”酰胺键,此类反应称为天然化学连接。实际上S-N酰胺反转最早于1953年被Wieland et al报道,但并没有在蛋白修饰上使用。后来NCL可以在生理条件下没有保护剂存在的条件下,选择性的连接两个功能分子。通过表达蛋白质连接(EPL,图4B)和蛋白质 - 反线剪接(PTS,图4C)中已经增加了NCL的许多应用。

图4、天然化学连接和基于Intein的技术
▉氨基酸序列实现生物正交的多样性

图5具有四半胱氨酸基序的重组蛋白特异性标记的荧光试剂
▉通过螯合金属的肽标签

图6、金属螯合的人工肽标签
自然界本身就存在一系列的酶,通过与辅因子的共同作用可以对蛋白进行共价修饰。来自大肠杆菌的生物素连接酶,BirA,可以biotin化修饰一个长度为15个氨基酸的多肽上的赖氨酸,从而实现非人工的biotin修饰(图7-1)。生物素连接酶的发现促进了其它酶介导的蛋白修饰的发展,其中谷氨酰胺转移酶就是一个例子,TGase可以催化谷氨酰胺与赖氨酸连接,实现蛋白标记。此外,还有许多其它催化酶LplA, FGE,SrtA等,可以对蛋白进行特定的修饰(图7)。

图7、通过酶催化进行蛋白修饰
▉生物正交反应
生物正交反应指的是在活体细胞或组织中能够在不干扰生物自身生化反应条件下可以进行的化学反应,细胞内可以发生多种正交反应,比如胺亲核试剂与酮/醛的缩合(图8-1)、叠氮化物和三芳基膦的Staudinger反应(图8-2)、click反应(图8-3;8-4),click反应中最常见的是炔基和叠氮反应,常见的有环辛炔以及其衍生物,如8-3右图所示,近几年分子量较小的反应基团逐渐被开发,例如环丙烯、重氮基团等,还有目前最常用的四嗪与TCO的组合,该反应十分迅速,已在很多领域得到应用(图8-4)【5-6】click反应常用于靶点垂钓,寻找小分子在体内的作用靶蛋白。
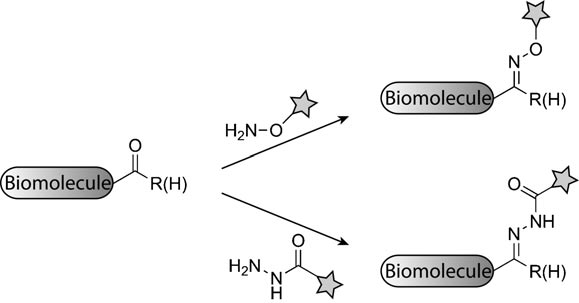

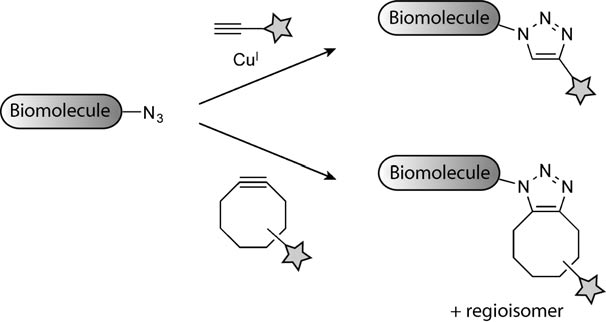
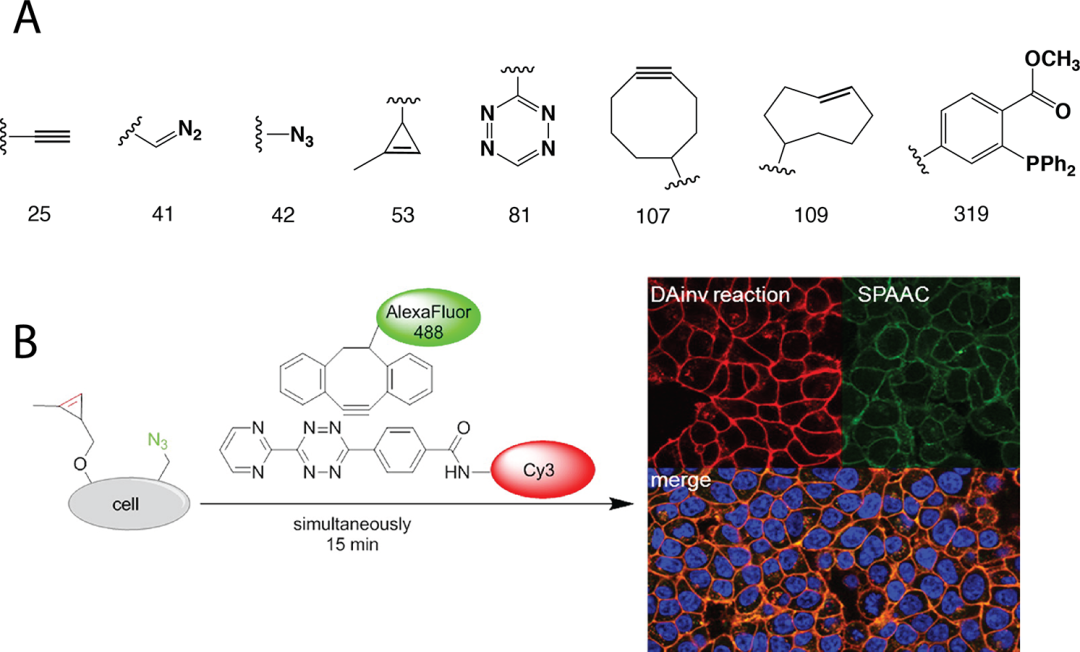
▉生物正交反应的应用
1. 代谢标记和基因编辑
在过去几十年中, 科学家们为了在蛋白质中加入非天然氨基酸(noncanonical amino acids, ncAAs)做了各种尝试,基因密码子扩展(GCE)技术便是其中之一,其能实现在生物体内任意目标蛋白的特定位点引入非天然氨基酸.这一技术是利用与宿主细胞生物正交的氨酰-tRNA合成酶/tRNA对(aminoacyl-tRNA. synthetase, aaRS)/tRNA pairs), 利用终止密码子(UAG/UGA/UAA)编码非天然氨基酸。迄今为止,大约有200个非天然氨基酸插入到蛋白质中,其中引入包括含有生物正交官能团(比如四嗪,叠氮,炔基)的非天然氨基酸,进而可以实现蛋白质的定点修饰。目前该技术在基础研究以及临床应用都展现出了较为突出的优势。(如图9)。

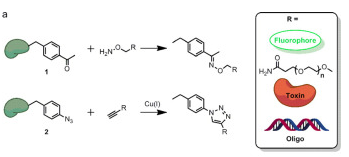
图9将非天然氨基酸掺入蛋白质中的流程及标签
2.基于活性的酶标记
基于活性的蛋白质分析(ABPP)通常通过含有靶头的分子与细胞孵育之后,裂解之后,通过含有荧光团或者生物素的探针分子与其发生正交反应之后,可以通过荧光成像或富集洗脱等来研究化合物的作用机制。但这种大探针通常具有较差的药代动力学性质,因此,不能在其本地环境中研究酶活性。研究ABPP的开创者为B. F. Cravatt 和H. S. Overkleeft,感兴趣的同学可以深层次了解其工作【2-3】。
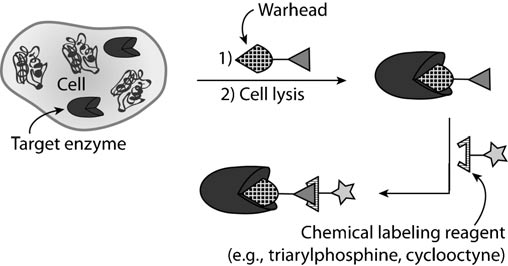
▉总结
在过去十年中,生物正交反应已成为化学生物学家的基本工具。他们已经开辟了新的研究方法,并在蛋白质生物物理学,神经生理学,发育和干细胞生物学和癌症检测中产生了新的发现。
化学标记对小分子代谢物的研究一种未来的新方向,辅因子和胆固醇是重要的研究对象。值得注意的是,Burkart和Marquez的研究组已经在将生物正交化学策略扩展到泛酰巯基乙胺辅因子的分析以及黄酮-8-乙酸的作用机制研究,总之生物正交化学将发展新的化学反应和生物靶标很好的结合了起来。
【1】S. D. Tilley, N. S. Joshi, M. B. Francis in The Wiley Encyclopedia of Chemical Biology (Ed.: T. Begley), Weinheim, 2008.
【2】A. E. Speers, G. C. Adam, B. F. Cravatt, J. Am. Chem. Soc. 2003, 125, 4686.
【3】H. S. Overkleeft, Angew. Chem. 2003, 115, 3754;
【4】Carolyn R Bertozzi.Angew Chem Int Ed Engl.2009;48(38):6974-98
【5】Devaraj, N.K., 2018. The Future of Bioorthogonal Chemistry. ACS Central Science 4, 952–959.
【6】Andersen,K.A..Diazo groups endure metabolism and enable chemoselectivity in cellulo.J.Am.Chem.Soc.2015,137,2412−2415.





